
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
分析 A.引入新的杂质气体氧气;
B.硝酸浓度降低时生成NO;
C.Fe与S混合加热生成FeS;
D.固氮应为氮气生成化合物.
解答 解:A.一氧化氮和氧气反应生成二氧化氮,一氧化氮中混有二氧化氮杂质,通入氧气可将一氧化氮转化为二氧化氮,但引入新的杂质气体氧气,故A错误;
B.过量的铜与浓硝酸反应,随着反应的进行,硝酸的浓度逐渐减小,稀硝酸与铜反应生成一氧化氮,故B正确;
C.S具有弱氧化性,Fe与S混合加热生成FeS,故C错误;
D.固氮应为氮气生成化合物,故D错误.
故选B.
点评 本题主要考查了元素化合物知识,侧重考查了氮的氧化物的性质,掌握一氧化氮、二氧化碳、合成氨原理是解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
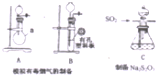 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.99 | 23.00 | 20.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
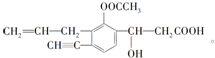
 +NaHCO3→
+NaHCO3→ +CO2↑+H2O.
+CO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
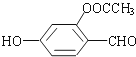 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时 NH4Cl 溶液的 KW 大于 100℃时 NaCl 溶液的 KW | |
| B. | SO2 通入碘水中,反应的离子方程式为 SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 加入铝粉能产生 H2 的溶液中,可能存在大量的 Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
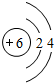
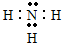
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com