
下列装置或操作与实验目的最相符的是
| A.①——实验室制取并收集足量NH3 |
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
科目:高中化学 来源: 题型:单选题
用如图所示的装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 选项 | 气体 | a | b | c |
| A | CO2 | 稀盐酸 | 石灰石 | 浓硫酸 |
| B | SO2 | 浓硫酸 | 铁片 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是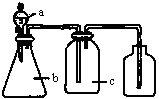
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下图装置不能完成气体制取任务的是
| A.过氧化钠和水反应制取氧气 |
| B.生石灰和浓氨水反应制取氨气 |
| C.二氧化锰和浓盐酸反应制取氯气 |
| D.碳化钙和饱和食盐水反应制取乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下: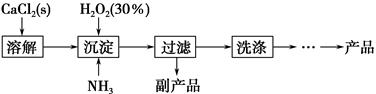
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。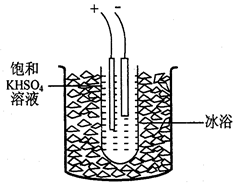
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为 。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是 。
(4)步骤5回收乙醇、乙醚时采用的操作方法是 。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com