
【题目】汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化: 2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=﹣283kJmoL﹣1 . 几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能kJ/mol﹣1 | 945 | 498 | 630 |
已知:N2(g)+O2(g)=2NO(g)△H3 , 则:△H1= .
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为 c(K+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),则负极的反应式为;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5~10min,用CO的浓度变化表示的反应速率为:
②能说明上述反应达到平衡状态的是
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:;在时间15﹣20,t1﹣t2 , t2﹣t3 , t4﹣t5时的平衡常数分别为K1、K2、K3、K4 , 请比较各平衡常数的大小关系: . 
【答案】
(1)﹣749kJ?moL﹣1
(2)2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O
(3)0.056mol/(L.min);BD;变大;0.11;降低温度;K1=K2=K3<K4
【解析】解:(1)焓变=反应物键能总和﹣生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol﹣630kJ/mol×2=+183 kJmoL﹣1 , CO的燃烧热△H2=﹣283kJmoL﹣1 , 即2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol ②,②﹣①得到2CO(g)+2NO(g)N2(g)+2CO2(g),所以2CO(g)+2NO(g)N2(g)+2CO2(g),△H1=﹣566kJ/mol﹣183 kJmoL﹣1=﹣749kJmoL﹣1 , 所以答案是:﹣749kJmoL﹣1;(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O,所以答案是:2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O;(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2)=4× ![]() =0.056mol/(L.min),所以答案是:0.056mol/(L.min);②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
=0.056mol/(L.min),所以答案是:0.056mol/(L.min);②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.气体密度一直不变,故错误;
D.容器内气体压强不变,反应达平衡状态,故正确;故选:BD;
③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动,所以二氧化氮的转化率变大,所以答案是:变大;
④
4CO(g)+ | 2NO2(g) | N2(g)+ | 4CO2(g) | |
初起浓度: | 2 | 2 | 0 | 0 |
变化浓度: | 1 | 0.5 | 0.25 | 1 |
平衡浓度: | 1 | 1.5 | 0.25 | 1 |
所以K= ![]() =0.11,所以答案是:0.11;
=0.11,所以答案是:0.11;
⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小,其中15﹣20是增大压强,t1﹣t2是使用催化剂,t2﹣t3时降低温度,t4﹣t5时温度不变,所以K1、K2、K3、K4的大小关系为:降低温度;K1=K2=K3<K4 .
【考点精析】掌握反应热和焓变和化学平衡状态本质及特征是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】下列各组物质中,第―种是酸,第二种是混合物,第三种是碱的是
A. 硫酸、CuSO4 ·5H2O、苛性钾 B. 硫酸、冰水混合物、烧碱
C. 硝酸、食盐水、苛性钠 D. 盐酸、蔗糖水、生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如图: 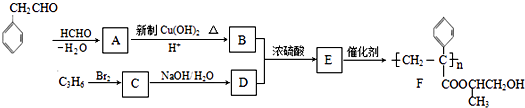
已知:HCHO+RCH2CHO→ 
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是 , C的系统命名为
(2)检验B中所含官能团所用的试剂有;E→F的反应类型是 .
(3)G物质的相对分子质量比 ![]() 的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
(4)C生成D的反应化学方程式为 , 如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线
的合成路线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,M、N能在溶液中发生反应生成P和Q:![]() 。
。
A.将0.2 mol·L-1 M溶液和0.2 mol·L-1 N溶液各20 mL混合
B.将0.5 mol·L-1 M溶液和0.5 mol·L-1 N溶液各50 mL混合
C.将1 mol·L-1 M溶液和1 mol·L-1 N溶液各10 mL混合,同时倒入30 mL蒸馏水
D.将1 mol·L-1 M溶液20 mL和1.2 mol·L-1 N溶液60 mL混合
反应开始时,反应速率由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用.其制备路线如下: 
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl].
(1)写出物质A的名称: .
(2)SnCl2用盐酸而不用水溶解的原因是(用化学方程式表示).
(3)锡粉的作用是除去酸溶时产生的少量Sn4+ , 请写出产生Sn4+的离子方程式: .
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:;该反应的温度需要控制在75℃左右的原因是 .
(5)实验室中“漂洗”沉淀的实验操作方法是;如何鉴别是否漂洗干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaAlH4晶体中(晶胞结构如图),与阴离子AlH4﹣空间构型相同的两种离子(填化学式),与Na+紧邻且等距的AlH4﹣有个;若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为(填化学式). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.I A族元素都是金属元素
B.在第三周期主族元素中Na的原子半径最大
C.焰色反应是一种复杂的化学变化
D.碱金属元素的化合物焰色反应均显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子个数都减少的是
A. CuSO4 B. Ca(NO3)2 C. Na2CO3 D. FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com