
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
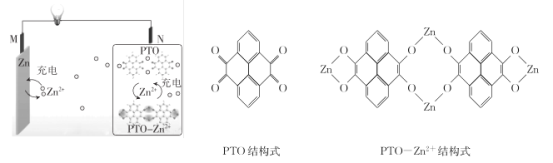
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
【答案】D
【解析】
放电时,金属Zn发生失电子的氧化反应生成Zn2+,即M电极为负极,则N电极为正极,电极反应式为2PTO+8e-+4Zn2+═PTO-Zn2+;充电时,外加电源的正极连接原电池的正极N,外加电源的负极连接原电池的负极。
A. 该原电池中,放电时M电极为负极,N电极为正极,正极得电子发生还原反应,故A正确;
B. 充电时,原电池的负极M连接外加电源的负极作阴极,电解质中阳离子Zn2+移向阴极M,故B正确;
C. 放电时,正极反应式为2PTO+8e-+4Zn2+═PTO-Zn2+,负极反应式为Zn-2e-=Zn2+,电子守恒有4Zn~PTO-Zn2+,所以每生成1molPTO-Zn2+,M极溶解Zn的质量=65g/mol×4mol=260g,故C正确;
D. 充电时,原电池的正极N连接外加电源的正极作阳极,发生失电子的氧化反应,电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+,故D错误;
故选:D。


科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。下列有关该电池说法正确的是
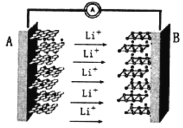
A.A电极为该电源的负极,电极材料主要是金属锂和石墨烯
B.B电极的反应:2Li++S8﹣2e=Li2S8
C.充电时,电极A与电源负极连接,作为阴极
D.为提高电池效率,该电池可选用稀硫酸作为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石是一种化工原料,可以通过反应生成一系列物质,如图:

下列说法正确的是
A.漂粉精是混合物,有效成分是氯化钙
B.图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2
C.工业制漂粉精通常用氯气通入澄清石灰水中
D.制取纯碱和漂粉精所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-苯基丙烯酸可用于合成人造龙涎香,现以甲苯为原料,按下列方法合成(从F开始有两条合成路线)
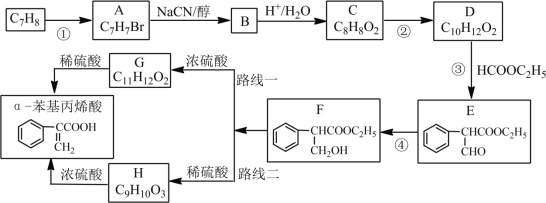
已知:①CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
②CH3CH2CN ![]() CH3CH2COOH
CH3CH2COOH
完成下列填空:
(1)写出反应④的反应类型是________反应;写出反应①所需试剂与条件是 _________。
(2)写出C的结构简式:_____________________。
(3)写出一种符合下列条件的F的同分异构体___________________。
①氧原子不与苯环直接相连;②能发生银镜反应;③1mol该物质与足量钠反应产生1mol氢气;④有5种不同氢原子。
(4)检验E是否完全转化为F的方法是_____________________。
(5)路线二与路线一相比不太理想,理由是_______________________。
(6)利用已知条件,设计一条由![]() 制备
制备![]() 的合成路线。___________________________
的合成路线。___________________________
(合成路线的表示方法为![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内H2的平均反应速率为0.1 mol·L-1·min-1,则经过时间为( )
A. 2 minB. 3 minC. 4 minD. 5 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应![]() 的ΔH为____________________。
的ΔH为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种高效氧化剂可用来氧化吸附有机异味物.也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的_______区,基态Mn2+的核外电子排布式可表示为_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共价键数目为__________。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为_______.C2O42-中碳原子的轨道杂化类型是___________________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
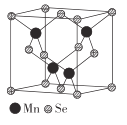
①β-MnSe中Mn的配位数为_____________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为______pm, β-MnSe 的密度ρ= ______ ( 列出表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com