
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
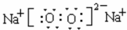 ,
,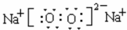 ;
;

科目:高中化学 来源: 题型:

| A、加热时,③溶液变红,冷却后又变为无色 |
| B、加热时,②溶液变红,冷却后又变为无色 |
| C、加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| D、四个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 原子半径(nm) | 0.066 | 0.104 | 0.117 | 0.137 |
| 常况下单质色态 | 无色气体 | 淡黄色固体 | 灰色固体 略带金属光泽的 | |
| 主要单质熔点(℃) | -218.4 | 113 | 217 | 450 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含碳元素的化合物都是有机物 |
| B、完全燃烧只生成CO2和H2O的化合物都是烃 |
| C、大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键 |
| D、有机物完全燃烧只可能生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图甲为用氢气还原氧化铜的微型快速实验装置,实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的小匙,将铜丝2一段弯曲成螺旋状,试回答下列问题:
如图甲为用氢气还原氧化铜的微型快速实验装置,实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的小匙,将铜丝2一段弯曲成螺旋状,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知I、II反应在一定条件节焓变及平衡常数如下:
已知I、II反应在一定条件节焓变及平衡常数如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①②③ |
| C、①②⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com