
���� ��1������n=$\frac{m}{M}$����24.4 g NaOH�����ʵ������ٸ���c=$\frac{n}{V}$��������������Һ�����ʵ���Ũ�ȣ�
��2������m=��V������Һ���������ٸ���������������=$\frac{m�����ʣ�}{m����Һ��}$��100%���㣻
��3����Һ�Ǿ��ȵģ�ȡ����10mL��Һ�Լ�ʣ�����Һ��ԭ��Һ��ȣ��������Ƶ��������������ʵ���Ũ�Ȼ���Һ���ܶȾ���ͬ����10mL��Һ���������Ƶ�����Ϊԭ��Һ��$\frac{1}{10}$��
��4����ȡ����10mL��Һ��ˮϡ�͵�100mL���������10 ����Ũ����С10 ����
��� �⣺��1��24.4 g NaOH�����ʵ���Ϊ$\frac{24.4g}{40g/mol}$=0.61 mol����c��NaOH��=$\frac{0.61mol}{0.1L}$=6.1 mol/L��
�ʴ�Ϊ��6.1 mol/L��
��2��100 mL NaOH��Һ������Ϊ100 mL��1.219 g/mL=121.9 g����NaOH����������Ϊ$\frac{24.4g}{121.9g}$��100%=20%��
�ʴ�Ϊ��20%��
��3����Һ�Ǿ��ȵģ�ȡ����10mL��Һ�Լ�ʣ�����Һ��ԭ��Һ��ȣ��������Ƶ����ʵ���Ũ�Ȳ���Ϊ6.1mol/L��NaOH�������������䣬��Һ���ܶȲ��䣬Ϊ��10mL��Һ���������Ƶ�����Ϊԭ��Һ��$\frac{1}{10}$����10mL������������Һ��m��NaOH��=24.4g��$\frac{10mL}{100mL}$=2.44g����NaOH�����ʵ���Ϊ0.61 mol��$\frac{1}{10}$=0.061mol��
�ʴ�Ϊ��6.1mol/L��20%��1.219g/mL��2.44g��0.061mol��
��4����ȡ����10mL��Һ��ˮϡ�͵�100mL���������10 ����Ũ����С10 ��������Ũ��Ϊ��0.61mol/L���ʴ�Ϊ��0.61mol/L��
���� ���⿼�����ʵ���Ũ�ȡ������������йؼ��㣬�Ƚϻ�����ּ�ڿ���ѧ���Ի���֪ʶ���������գ�ע��Զ���ʽ��������������ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȶ��ԣ�HCl��HI | B�� | O2��O3��Ϊͬ�������� | ||
| C�� | ���ԣ�HClO4��H2SO4��H3PO4��H2SiO3 | D�� | �ɱ��ͱ�Ϊͬһ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������4��һ���Ƿǽ���Ԫ�� | |
| B�� | Ԫ�����ڱ���18���У�7���У�����18���壬7������ | |
| C�� | �ڢ�A����Ǽ���� | |
| D�� | ij��A��Ԫ�ص�ԭ������Ϊa�������ͬ���ڢ�A��Ԫ�ص�ԭ����������Ϊa+11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
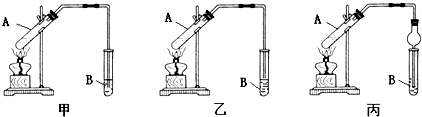
| A�� | ����ʵ��װ����ȷ����˳�����ʵ������Һͱ� | |
| B�� | �Թ�B��ʢ�ŵ�Һ����NaOH��Һ | |
| C�� | ���Թ�A��Ӧ�Ӽ������Ƭ�Է�ֹA�е�Һ�����ʱ�������� | |
| D�� | ��Ӧ���������Թ�B��B��Һ���Ϊ���㣬�ϲ�Ϊ��ɫ��״Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽�� | ʵ������ |
| ��ȡ��������Һ������NaOH��Һ | �а�ɫ�������ɣ���NaOH����ʱ�����������ܽ� |
| ��ȡ��������Һ������ͭƬ��Ũ���ᣬ���� | ����ɫ������������������Ա�ɺ���ɫ |
| ��ȡ��������Һ������BaCl2��Һ | �а�ɫ�������� |
| ��ȡ���е��ϲ���Һ������AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
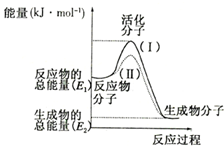 �ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mo1��ʾ��������۲���ͼ��Ȼ��ش����⣺
�ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mo1��ʾ��������۲���ͼ��Ȼ��ش����⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
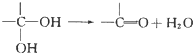
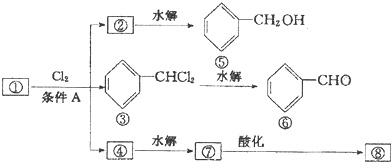
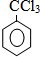 ��
��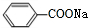 ��
��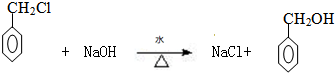 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��Ӧ��ʹ��ˮ��ɫ | B�� | ����H2�����ӳɷ�Ӧ | ||
| C�� | ����Ũ���ᡢŨ���ᷢ��ȡ����Ӧ | D�� | ����ʹ���Ը��������Һ��ɫ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com