
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 零 |
2 | ① | ② | ③ | |||||
3 | ④[ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
【答案】(每空2分,共14分)
(1)Ar
(2)HClO4
(3)非电解质;![]()
(4)Al2O3+ 2OH—= H2O + 2AlO2—
(5)离子键、共价键;2Na2O2+ 2CO2= 2Na2CO3+ O2↑
【解析】
试题由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar。
(1)稀有气体Ar的化学性质最不活泼,则化学性质最不活泼的为Ar。
故答案为:Ar;
(2)以上元素中,最高价氧化物对应水化物的酸性最强的为高氯酸,化学式为HClO4。
故答案为:HClO4;
(3)②的氢化物为NH3,氨气为非电解质;元素⑦与④形成化合物为NaCl,氯化钠为离子化合物,其电子式为:![]() 。
。
故答案为:非电解质;![]() ;
;
(4)⑤为Al元素,其最高价氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-。
故答案为:Al2O3+2OH-=H2O+2AlO2-;
(5)元素④的某氧化物可作供氧剂,该氧化物为过氧化钠,过氧化钠中所含的化学键类型有离子键和共价键;过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2。
故答案为:离子键、共价键;2Na2O2+2CO2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】标准状况下;用惰性电极电解200 mL NaCl、CuSO4的混合溶液;阴、阳两极所得气体的体积随时间变化如图所示;则 c(CuSO4)为
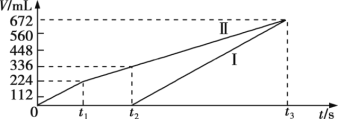
A. 0.10 mol·L1 B. 0.15 mol·L1 C. 0.20 mol·L1 D. 0.25 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石灰水保存鲜蛋是一种化学保鲜法。石灰水能保存鲜蛋的原理是
①石灰具有强碱性,杀菌能力强;
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用;
③石灰水是电解质溶液,能使蛋白质凝聚;
④石灰水能渗入蛋内中和酸性物质。
A. ①②B. ③④C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
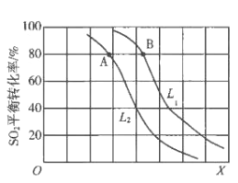
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[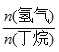 ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
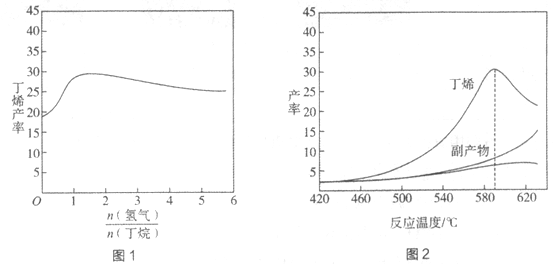
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[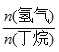 ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是
A. 0.25L B. 0.5L C. 0.75L D. 1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 2.0mol/L的盐酸中Cl—的物质的量为( )
A. 2.0mol B. 0.20mol C. 1.0mol D. 0.10mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com