
| A.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等 |
| B.中和等体积pH=11的氢氧化钠溶液,所需pH=3醋酸溶液的体积大于pH=3盐酸的体积 |
| C.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,浓度关系: c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl) |
| D.酸式盐NaHA的水溶液呈碱性,离子的物质的量浓度关系:c(Na+)>c(HA—)>c(OH—)>c(H+)>c(A2—) |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)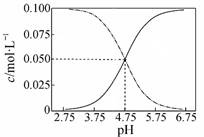 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.①③⑤ | C.③⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是| A.溶液①中,C(CH3COO-)=C(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+) |
| D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com