


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、KNO3 |
| B、NaCl |
| C、AgNO3 |
| D、CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由2H和18O组成的水11 g,所含的中子数为4NA |
| B、标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA |
| C、在0.1 mol?L-1的醋酸溶液中,所含H+的个数小于0.1NA |
| D、室温下H2O2分解得到16 g O2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I

查看答案和解析>>
科目:高中化学 来源: 题型:
| w(X) | w(Y) | 101.3kPa、t℃时密度(g/L) | 沸点(℃) | |
| A | 0.111 | 0.889 | 1000(4℃) | 100 |
| B | 0.200 | 0 | 1.34(0℃) | -88.6 |
| C | 0.125 | 0.500 | - | 64. 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
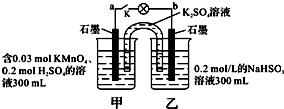
| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com