
| A. | 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化铁与盐酸反应H++OH-=H2O | |
| C. | 氯化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ | |
| D. | 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg |
分析 A.氢氧化钙应拆成离子形式;
B.氢氧化铁应保留化学式;
C.氯化钡溶液与稀硫酸混合,反应生成盐酸与硫酸钡沉淀;
D.电荷不守恒.
解答 解:A.澄清石灰水与盐酸混合,反应离子方程式:H++OH-=H2O,故A错误;
B.氢氧化铁与盐酸反应,反应离子方程式:Fe(OH)3+3H+=Fe3++3H2O,故B错误;
C.氯化钡溶液与稀硫酸混合,离子方程式:Ba2++SO42-=BaSO4↓,故C正确;
D.铝与硝酸汞溶液反应,离子方程式:2Al+3Hg2+=2Al3++3Hg,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确物质拆分原则、电荷守恒规律、原子个数守恒规律即可解答,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 如图所示的反应为吸热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热才有发生的反应一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的原子结构示意图: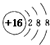 | |
| B. | NH4Br的电子式: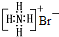 | |
| C. | Be2+离子中的质子数和电子数之比为2:1 | |
| D. | 中子数为146、原子序数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
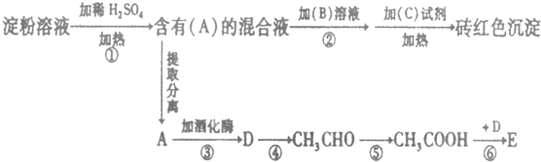
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
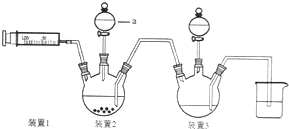 二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molNO和1molCO2 | B. | 1molCO2和2molNH3 | ||
| C. | 1molCl2和lmolSO2 | D. | 1molNO2和lmolSO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com