
科目: 来源:不详 题型:单选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
| A.在t3时刻反应已经停止 | ||
| B.A的转化率比B的转化率低 | ||
| C.在容器中发生的反应为:2A+B≒2C | ||
D.在t2~t3内A的平均反应速率为:[
|
查看答案和解析>>
科目: 来源:不详 题型:问答题
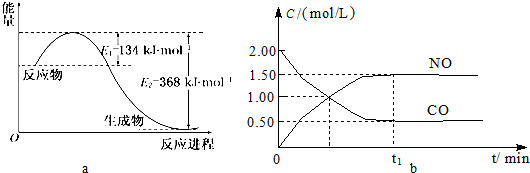
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO |
2mol NO 2mol CO2 |
1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:填空题
| . |
| v |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源:大兴区一模 题型:单选题
| 反应时间(min) | 0 | 5 | 15 | 17 | 20 |
| X的浓度(mol/L) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
| A.0~5min时,该反应的速率为v(X)=0.12 mol/(L?min) |
| B.5min时反应达到第一次平衡,该温度下的平衡常数数值为0.625 |
| C.15min时改变的条件不可能是升高温度 |
| D.从初始到18min时,X的转化率为30% |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
| A.反应I2(aq)+I-?I3-(aq)的△H>0 | ||||
| B.其他条件不变,升高温度,溶液中c(I3-)减小 | ||||
C.该反应的平衡常数表达式是K=
| ||||
| D.25℃时,向溶液中加入少量KI固体,平衡常数K小于680 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应进行到2 min时,容器中n(SO3)可能为0.5 mol |
| B.当v(SO2):v(O2):v(SO3)=2:1:2时该反应达平衡状态 |
| C.温度升高时正反应速率增大,逆反应速率减小 |
| D.4 min内氧气的平均反应速率为0.5 mol?L-1?min-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.5% | B.10% | C.15% | D.20% |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.常温下,由NH4Cl和NH3?H2O组成的混合液pH一定大于7 |
| B.18g由14C原子形成的甲烷中所含有的C─H键的个数为4NA |
| C.向2mol/L的CH3COOH溶液中加入等体积1mol/L的NaOH溶液后的混合液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.某温度时,在恒容的容器中反应2SO2(g)+O2(g)?2SO3(g)达到平衡时,向体系中充入SO2气体,平衡向正反应方向移动,SO2的转化率提高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com