
科目: 来源:浙江省模拟题 题型:单选题
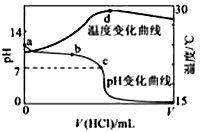
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
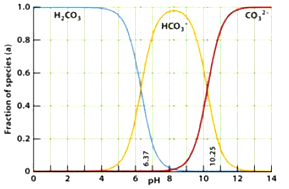
查看答案和解析>>
科目: 来源:云南省期中题 题型:单选题
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
 溶液和CH3COONa溶液,
溶液和CH3COONa溶液,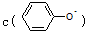 <c(CH3COO-)
<c(CH3COO-) 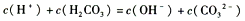
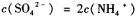
查看答案和解析>>
科目: 来源:海南省期中题 题型:填空题
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
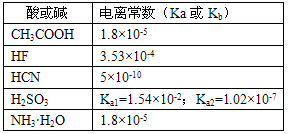
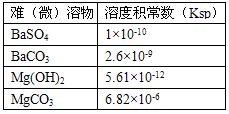
查看答案和解析>>
科目: 来源:江苏模拟题 题型:不定项选择题
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com