
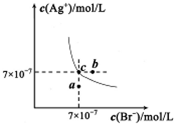
科目: 来源:菏泽二模 题型:单选题
| A.在t℃时,AgBr的Ksp为4.9×l0-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
| D.在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目: 来源:无锡一模 题型:填空题
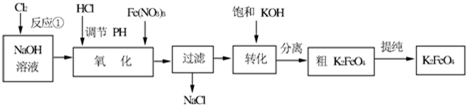
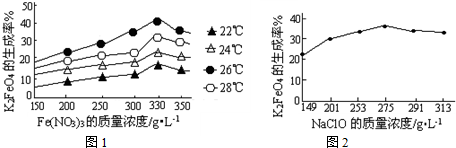
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:河东区二模 题型:单选题
| A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10 |
| B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸 ③0.1mol/L氯化镁溶液④0.1mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③ |
查看答案和解析>>
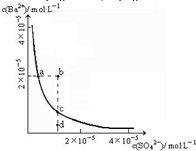
科目: 来源:不详 题型:单选题
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/c(CO32-)=4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol?L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口 |
| B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿 |
| C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大 |
| D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.HF与CaCl2反应产生沉淀 |
| B.25℃时0.2mol?L-1HF溶液中pH=2 |
| C.Ksp(CaF2)随温度和浓度的变化而变化 |
| D.该体系中最终没有氟化氢分子 |
查看答案和解析>>
科目: 来源:烟台模拟 题型:单选题
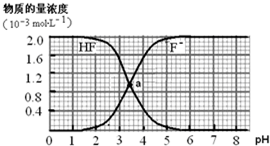
| A.两条曲线交点a对应溶液的[F-]=[HF] |
| B.加入NaOH溶液至pH=7,溶液中[F-]=[Na+] |
| C.常温下HF的电离常数Ka(HF)>Ka(CH3COOH) |
| D.pH=4时,加入CaCl2固体使[Ca2+]=2.0×10-3mol?L-1,无CaF2沉淀析出 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:河北省期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com