
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 Ba2+(aq)+ SO32-(aq) 平衡体系中,下列措施可使沉淀量减少的是
Ba2+(aq)+ SO32-(aq) 平衡体系中,下列措施可使沉淀量减少的是查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
A. NH3
B. 硝酸
C. 水
D. AgNO3
查看答案和解析>>
科目: 来源:同步题 题型:填空题
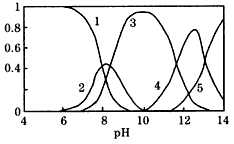
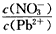 ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,
______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,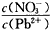 增加,可能的原因是___________________
增加,可能的原因是___________________ 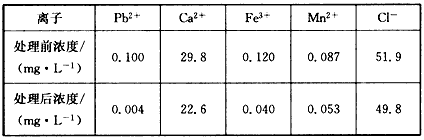
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
 (s)Mg2+(aq)+2OH- (aq)。下列有关说法不正确的是
(s)Mg2+(aq)+2OH- (aq)。下列有关说法不正确的是查看答案和解析>>
科目: 来源:同步题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:计算题
 Ag(sq)+Cl(aq),
Ag(sq)+Cl(aq),  2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知:
2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知: )
) 查看答案和解析>>
科目: 来源:同步题 题型:填空题
 Mg2++2OH-①
Mg2++2OH-①  NH3·H2O+H+②
NH3·H2O+H+② H2O③
H2O③ Mg2++2OH-①
Mg2++2OH-① NH3·H2O②
NH3·H2O② 查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题





查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com