
科目: 来源:四川省期中题 题型:实验题
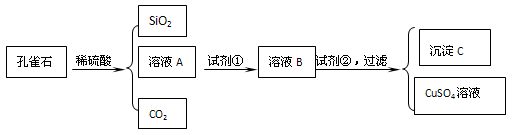
查看答案和解析>>
科目: 来源:四川省期中题 题型:实验题
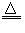 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 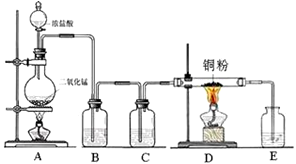
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。查看答案和解析>>
科目: 来源:上海模拟题 题型:单选题
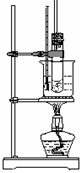
查看答案和解析>>
科目: 来源:广东省模拟题 题型:实验题
查看答案和解析>>
科目: 来源:山东省模拟题 题型:实验题

查看答案和解析>>
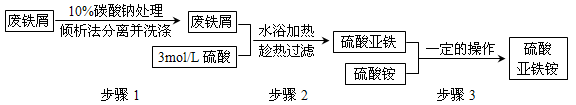
科目: 来源:四川省模拟题 题型:实验题
查看答案和解析>>
科目: 来源:安徽省模拟题 题型:实验题
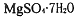 是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主耍成分是
是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主耍成分是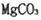 ,并含有
,并含有 杂质)制取
杂质)制取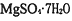 的实验,流程如下
的实验,流程如下
 ,洗涤沉淀的基本操作是___________________________________。
,洗涤沉淀的基本操作是___________________________________。  质量为82.00克,测得MnO2质量为1.74克,且测得第①步滤渣质量为4. 70克,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中
质量为82.00克,测得MnO2质量为1.74克,且测得第①步滤渣质量为4. 70克,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中 的质量分数为_______。
的质量分数为_______。 查看答案和解析>>
科目: 来源:湖北省模拟题 题型:实验题
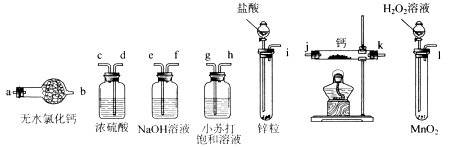
查看答案和解析>>
科目: 来源:江西省模拟题 题型:实验题

查看答案和解析>>
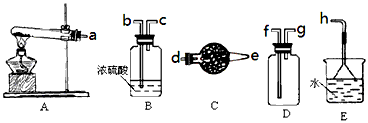
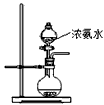
科目: 来源:河南省同步题 题型:实验题

 2BN + 3H2O)和如下装置制备氮化硼。
2BN + 3H2O)和如下装置制备氮化硼。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com