
科目: 来源:0110 期中题 题型:实验题
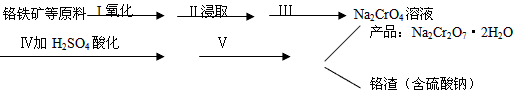

查看答案和解析>>
科目: 来源:0111 期末题 题型:实验题
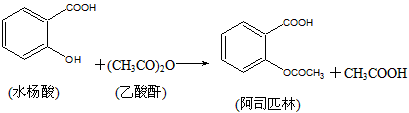
查看答案和解析>>
科目: 来源:上海模拟题 题型:实验题

查看答案和解析>>
科目: 来源:山西省月考题 题型:实验题
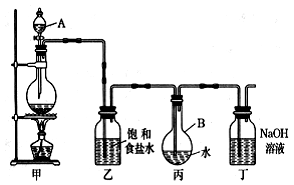
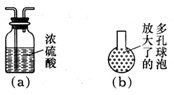
查看答案和解析>>
科目: 来源:江苏期中题 题型:不定项选择题

查看答案和解析>>
科目: 来源:广东省模拟题 题型:实验题


 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。 
查看答案和解析>>
科目: 来源:江苏期中题 题型:推断题

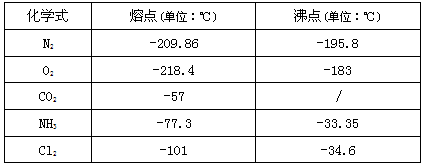
查看答案和解析>>
科目: 来源:江苏期中题 题型:实验题

查看答案和解析>>
科目: 来源:江西省模拟题 题型:实验题

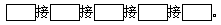
查看答案和解析>>
科目: 来源:江苏期中题 题型:实验题
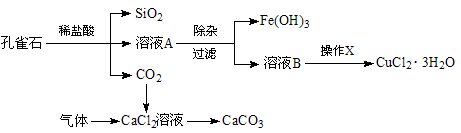
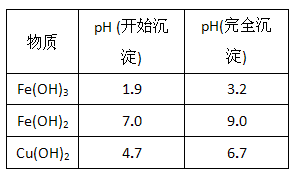
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com