
科目: 来源:山东省模拟题 题型:实验题

请回答下列问题:
(1)实验室用18.4 mol/L的浓硫酸配制250 mL 4.8 mol/L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需____ (填写仪器名称)。
(2)溶液X中加入铁粉后可能发生反应的离子方程式为____________________。
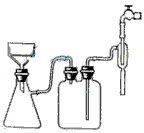
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题

查看答案和解析>>
科目: 来源:山东省模拟题 题型:实验题
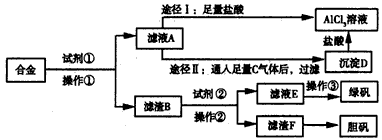
查看答案和解析>>
科目: 来源:安徽省模拟题 题型:实验题


查看答案和解析>>
科目: 来源:江苏模拟题 题型:实验题
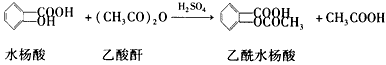
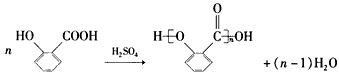

查看答案和解析>>
科目: 来源:模拟题 题型:计算题


查看答案和解析>>
科目: 来源:上海高考真题 题型:实验题
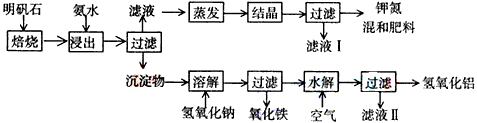
查看答案和解析>>
科目: 来源:同步题 题型:实验题
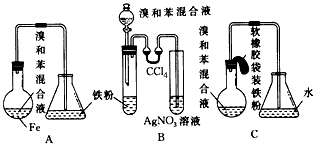
查看答案和解析>>
科目: 来源:专项题 题型:填空题


查看答案和解析>>
科目: 来源:专项题 题型:实验题
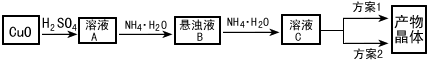
 Cu2++4NH3
Cu2++4NH3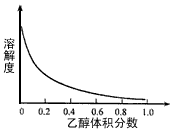
查看答案和解析>>
科目: 来源:模拟题 题型:实验题
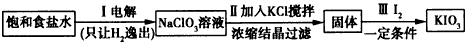
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com