
科目: 来源:同步题 题型:实验题
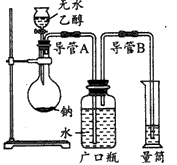
查看答案和解析>>
科目: 来源:上海模拟题 题型:实验题
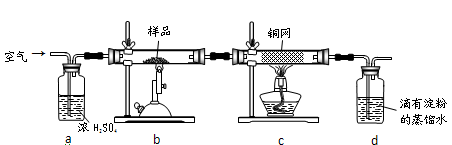
查看答案和解析>>
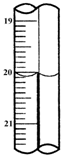
科目: 来源:同步题 题型:实验题
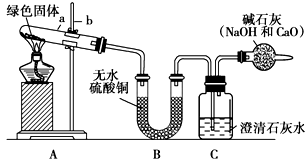
查看答案和解析>>
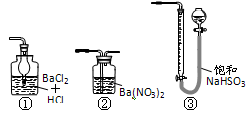
科目: 来源:云南省同步题 题型:实验题
查看答案和解析>>
科目: 来源:云南省同步题 题型:实验题
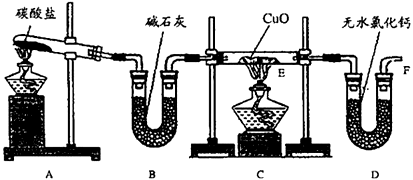
查看答案和解析>>
科目: 来源:云南省同步题 题型:实验题
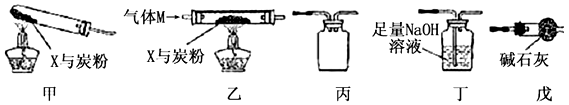

查看答案和解析>>
科目: 来源:云南省同步题 题型:实验题

 C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为________________。
C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为________________。
查看答案和解析>>
科目: 来源:专项题 题型:实验题
查看答案和解析>>
科目: 来源:宁夏自治区高考真题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com