
科目: 来源:0107 模拟题 题型:实验题

I.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作:____________________________________
(2)从导管a通入一定量的NO,并测得NO体积为VL(V<50ml,气体体积已经换算为标准状况)。准确测得NO体积的主要操作_____________________________。
II.验证NO的还原性;探究工业生产硝酸的原理
(3)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是_______________________________。写出对应现象的化学方程式____________________。
(4)继续通入O2,打开K3,并及时调整酸式滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
①当通入氧气的体积为1/2 V时,则广口瓶①的气体体积为_____________________
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为___________mol/L。
查看答案和解析>>
科目: 来源:同步题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:实验题
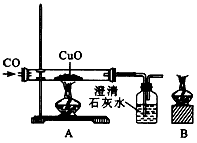
查看答案和解析>>
科目: 来源:专项题 题型:实验题
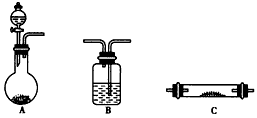
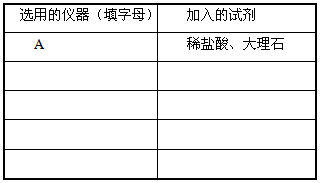
查看答案和解析>>
科目: 来源:专项题 题型:推断题
查看答案和解析>>
科目: 来源:专项题 题型:实验题
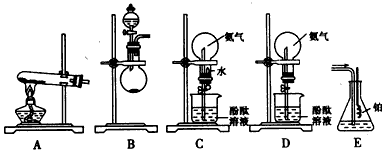
乙酸乙酯是重要的有机合成中间体,广泛应用于化工行业。
(1)写出实验室制备乙酸乙酯的化学方程式_________________________。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下四个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下
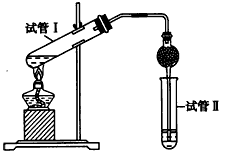

查看答案和解析>>
科目: 来源:专项题 题型:实验题
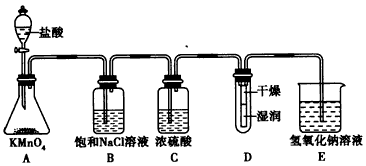
查看答案和解析>>
科目: 来源:专项题 题型:实验题
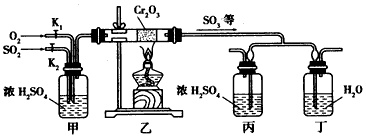
查看答案和解析>>
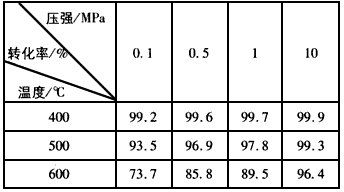
科目: 来源:专项题 题型:实验题
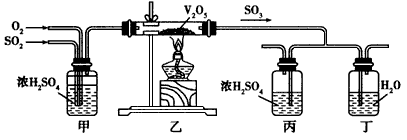
查看答案和解析>>
科目: 来源:0104 月考题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com