
科目: 来源:辽宁省模拟题 题型:实验题


查看答案和解析>>
科目: 来源:四川省模拟题 题型:实验题

查看答案和解析>>
科目: 来源:安徽省模拟题 题型:实验题


查看答案和解析>>
科目: 来源:湖北省模拟题 题型:实验题

查看答案和解析>>
科目: 来源:湖南省期末题 题型:实验题

查看答案和解析>>
科目: 来源:贵州省模拟题 题型:单选题

查看答案和解析>>
科目: 来源:河南省模拟题 题型:实验题


 Fe(SCN)2+来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol·L-1,c(SCN-)=0.1mol·L-1,c[Fe(SCN)2+]=0.68mol·L-1。则此温度下该反应的平衡常数K=_________。
Fe(SCN)2+来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol·L-1,c(SCN-)=0.1mol·L-1,c[Fe(SCN)2+]=0.68mol·L-1。则此温度下该反应的平衡常数K=_________。 查看答案和解析>>
科目: 来源:河北省模拟题 题型:实验题
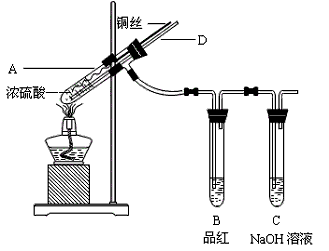

查看答案和解析>>
科目: 来源:0117 模拟题 题型:实验题

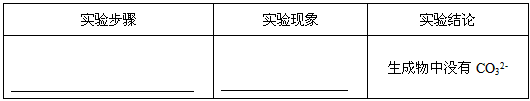

查看答案和解析>>
科目: 来源:0110 模拟题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com