
科目: 来源:专项题 题型:填空题
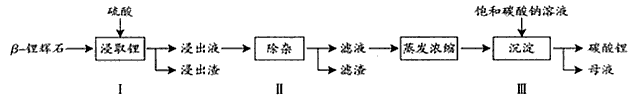
查看答案和解析>>
科目: 来源:专项题 题型:填空题
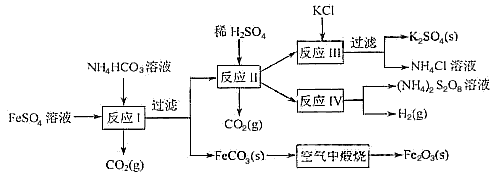
(1)反应Ⅰ前需在FeSO4溶液中加入_____(填字母),以除去溶液中的Fe3+
A.锌粉
B.铁屑
C.KI溶液
D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是_______________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_________________。
(4)反应Ⅳ常被用于电解生产 (NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为________________。
查看答案和解析>>
科目: 来源:同步题 题型:填空题

查看答案和解析>>
科目: 来源:期末题 题型:填空题
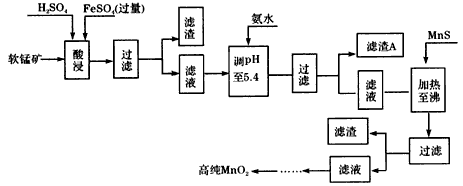
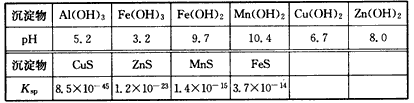
查看答案和解析>>
科目: 来源:期末题 题型:填空题



查看答案和解析>>
科目: 来源:期末题 题型:填空题
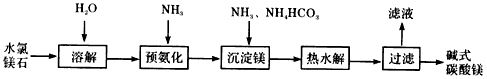
查看答案和解析>>
科目: 来源:同步题 题型:填空题
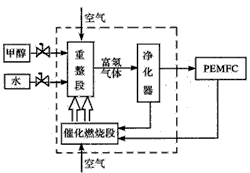
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
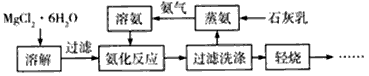
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
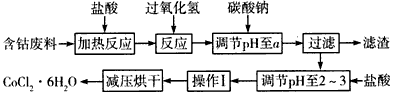
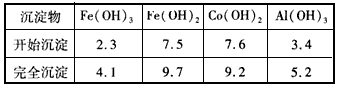
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
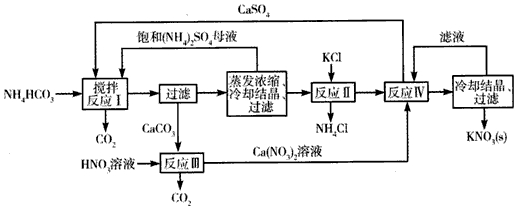
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com