
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:



| Cu |
| △ |
| Cu |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质查看答案和解析>>
科目: 来源: 题型:
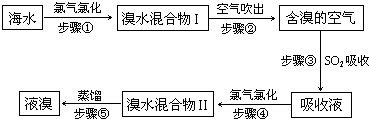
查看答案和解析>>
科目: 来源: 题型:
 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态. 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol| 2-a |
| 2 |
| 2-a |
| 2 |
| 6-3a |
| 2 |
| 6-3a |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com