
科目: 来源: 题型:
 (1)称量所需要的仪器是
(1)称量所需要的仪器是| bV |
| 200 |
| bV |
| 200 |
查看答案和解析>>
科目: 来源: 题型:
 (2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.
(2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.| c2(B) |
| c(A) |
| c2(B) |
| c(A) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
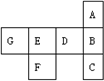 (2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.
(2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.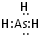
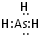
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
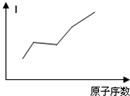
 (2010?卢湾区二模)氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3--SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
(2010?卢湾区二模)氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3--SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )查看答案和解析>>
科目: 来源: 题型:
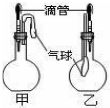 (2010?卢湾区二模)如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
(2010?卢湾区二模)如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com