
科目: 来源: 题型:填空题
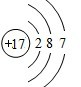 ,C元素离子电子式Na+.
,C元素离子电子式Na+. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{118}^{175}$X | B. | ${\;}_{175}^{118}$X | C. | ${\;}_{118}^{293}$X | D. | ${\;}_{293}^{118}$X |
查看答案和解析>>
科目: 来源: 题型:实验题
| 加热前质量 | 加热后质量 | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 5.4g | 7.9g | 6.8g |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题
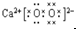 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
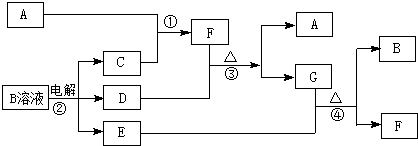
 ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com