
科目: 来源: 题型:选择题
| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 定容时未洗涤烧杯和玻璃棒 | |
| D. | 用带游码的托盘天平称2.4g NaOH 时误用了“左码右物”方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑧ | C. | ⑤⑦ | D. | ②④⑦ |
查看答案和解析>>
科目: 来源: 题型:实验题
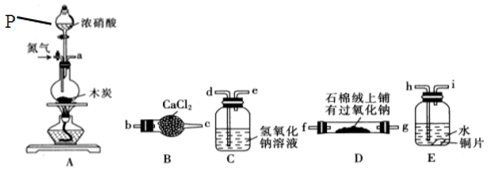
查看答案和解析>>
科目: 来源: 题型:解答题
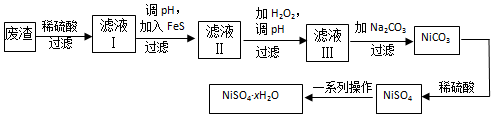
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com