
科目: 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
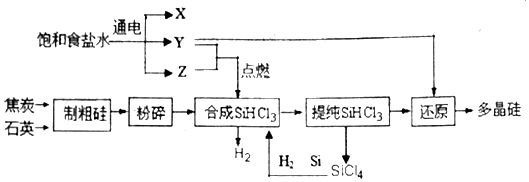
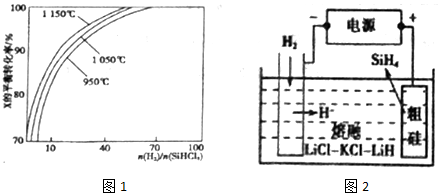
查看答案和解析>>
科目: 来源: 题型:选择题
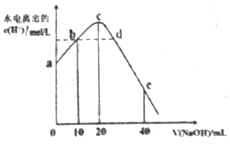 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
查看答案和解析>>
科目: 来源: 题型:选择题
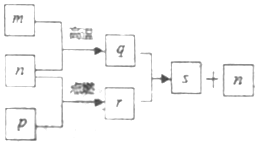 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 36g物质q与过量的物质r反应则有2mol电子发生转移 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 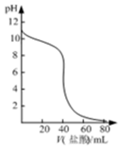 表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. | 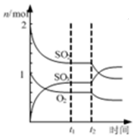 表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 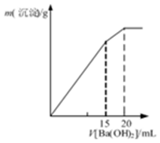 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 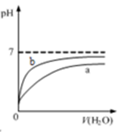 表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用10ml量筒量取7.13ml稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目: 来源: 题型:解答题
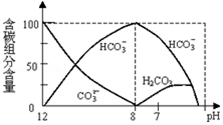 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gS02中含有的原子数为3NA | |
| C. | 40gNaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA | |
| D. | 标准状况下,11.2 LH20含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com