
科目: 来源: 题型:选择题
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同,平衡常数值为2 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为1.0 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
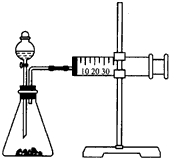
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
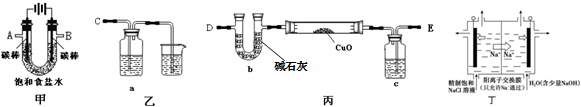
查看答案和解析>>
科目: 来源: 题型:填空题
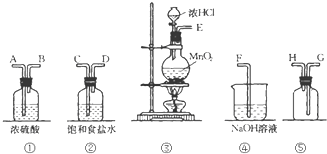 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目: 来源: 题型:解答题
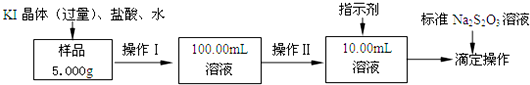
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com