
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
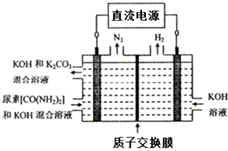 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目: 来源: 题型:解答题
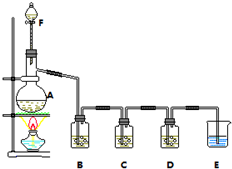 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目: 来源: 题型:解答题
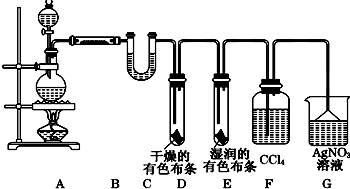
查看答案和解析>>
科目: 来源: 题型:解答题
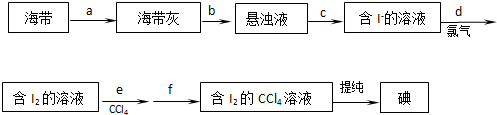
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
查看答案和解析>>
科目: 来源: 题型:解答题

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.查看答案和解析>>
科目: 来源: 题型:解答题
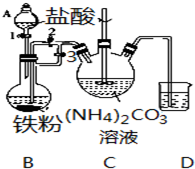 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目: 来源: 题型:解答题
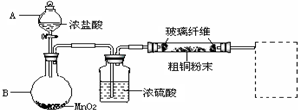
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com