
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ① | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:计算题
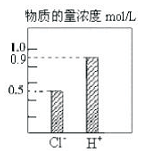 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 盐卤或石膏加入豆浆里制成豆腐 | |
| B. | 冶金厂利用高压直流电除去大量粉尘 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
科目: 来源: 题型:实验题
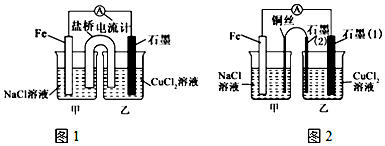
查看答案和解析>>
科目: 来源: 题型:解答题
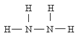 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.查看答案和解析>>
科目: 来源: 题型:选择题
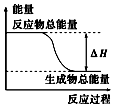
| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com