
科目: 来源: 题型:解答题
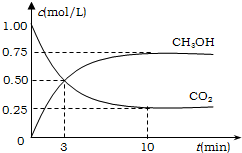 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
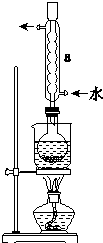 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:解答题
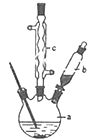 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: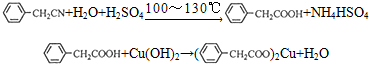
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
查看答案和解析>>
科目: 来源: 题型:解答题
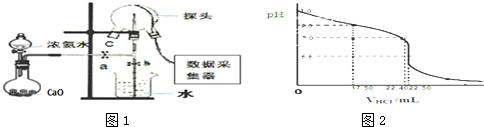
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定管用水洗后,未用标准溶液润洗就装入标准溶液 | |
| B. | 用于取待测液的滴定管未用待测液润洗 | |
| C. | 在摇动锥形瓶的过程中不慎溅出了一小部分溶液 | |
| D. | 标准液读数时,滴定前仰视,滴定后俯视 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
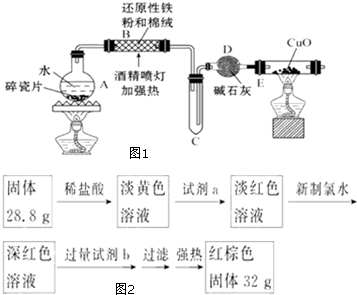 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com