
科目: 来源: 题型:解答题
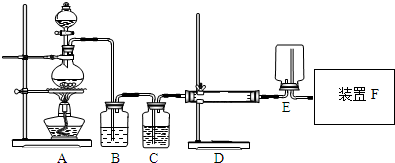

查看答案和解析>>
科目: 来源: 题型:解答题
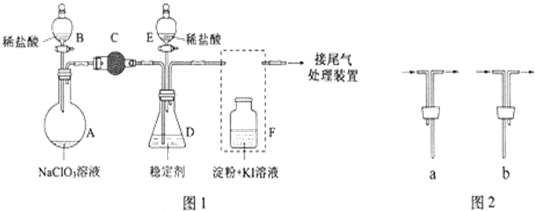
查看答案和解析>>
科目: 来源: 题型:选择题
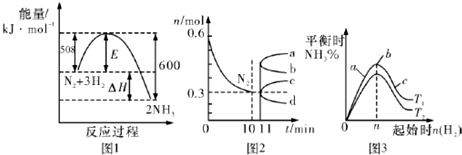
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
查看答案和解析>>
科目: 来源: 题型:解答题
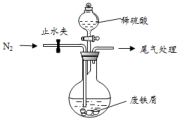 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目: 来源: 题型:填空题
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
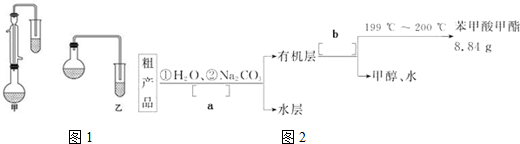
查看答案和解析>>
科目: 来源: 题型:解答题
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
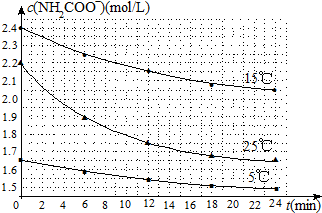
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目: 来源: 题型:解答题
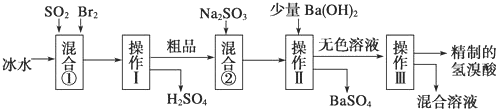
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com