
科目: 来源: 题型:实验题
| 化学键 | H-H | C-O | C≡O (CO中的化学键) | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
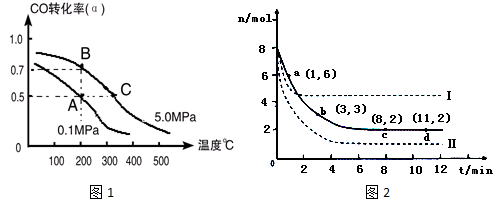
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 67% | B. | 50% | C. | 25% | D. | 10% |
查看答案和解析>>
科目: 来源: 题型:解答题
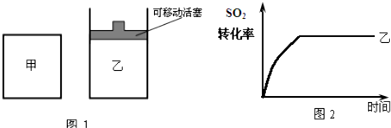
查看答案和解析>>
科目: 来源: 题型:解答题
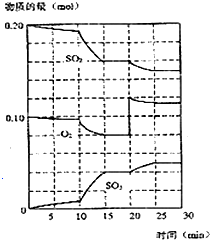 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1查看答案和解析>>
科目: 来源: 题型:解答题
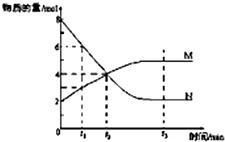 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目: 来源: 题型:解答题
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com