
科目: 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |

查看答案和解析>>
科目: 来源: 题型:解答题
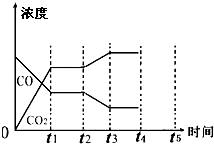 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
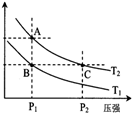 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 起始浓度(mol/L) | 1.5 | 1.0 | 0 |
| 2s末浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A和$\frac{n}{2}$molB,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A和n mol B,A、B的转化率均不变 | |
| D. | 如图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减小了A的浓度,增加了C的浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
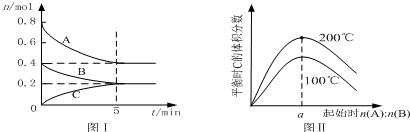
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl沉淀多于AgBr沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
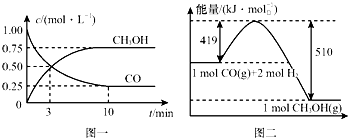 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com