
科目: 来源: 题型:选择题
| A. | HCl(aq)+NaOH (aq)═NaCl (aq)+H2O (l)△H<0 | |
| B. | 2CH3OH (l)+3O2 (g)═2CO2 (g)+4H2O (l)△H<0 | |
| C. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)═2H2O (l)△H<0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
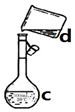 (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
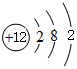 ,⑤
,⑤ .
.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
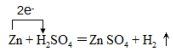 或
或 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com