
科目: 来源: 题型:选择题
| A. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 | |
| D. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 |
查看答案和解析>>
科目: 来源: 题型:推断题
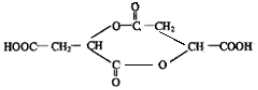 .
.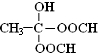 .(已知:
.(已知: )
)查看答案和解析>>
科目: 来源: 题型:推断题
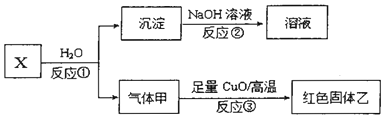
 写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.查看答案和解析>>
科目: 来源: 题型:解答题
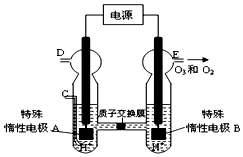 过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题: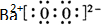 (写电子式),
(写电子式),查看答案和解析>>
科目: 来源: 题型:选择题
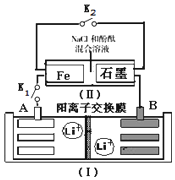 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO═SO42-+Cl-+2H+ | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO3-+10I-+12H+═5I2+Fe2++3NO↑+6H2O | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铈(Ce)元素在自然界中主要以化合态形式存在 | |
| B. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四种稳定的核素58136Ce、58138Ce、58140Ce、58142Ce,它们互称为同位素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 周期表中第15纵行(从左往右数)元素的最高正价为+5 | |
| B. | 元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 | |
| C. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| D. | 同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com