化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而含有碳酸钠杂质.学会从不同角度去分析问题一直是我们努力的方向,某化学研究性小组为测定混有碳酸钠的氢氧化钠样品的纯度提出如下几种实验方案.
方案一 称取m
1g样品溶于水,滴加足量BaC1
2溶液至沉淀完全,过滤、洗涤、干燥、称重得固体m
2g,计算NaOH的纯度.
(1)如何证明沉淀已洗涤干净
取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净)
取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净)
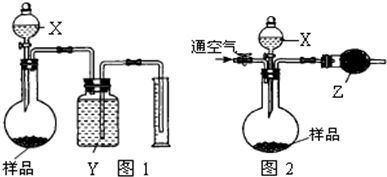
方案二 将m
1g样品放入圆底烧瓶中,分液漏斗中装入足量试剂X,测量产生CO
2的量有多种方式,该组甲、乙两位同学提出了不同方法.
甲同学利用图1装置测量产生CO
2的体积
乙同学利用图2装置测量产生CO
2的质量,乙同学的具体操作是:称量整个装置的质量为m
2g,加入足量试剂X使样品完全反应,然后通入足量的空气后称量整个装置的质量为m
3g.
(2)装置中的试剂分别是X:
稀硫酸
稀硫酸
Y:
饱和的碳酸氢钠溶液
饱和的碳酸氢钠溶液
Z:
无水CaCl2
无水CaCl2
图1装置反应后烧瓶中总会留有CO
2否
否
(填“是”、“否”)影响测出的CO
2的体积.
图2装置中若没有通空气的操作,则测得NaOH的纯度
偏高
偏高
(填“偏高”、“偏低”)
方案三 称取m g样品配成 V mL溶液,取V
1 mL溶液滴加过量的BaCl
2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,测出消耗盐酸的体积为V
2 mL,用m、V、V
1、V
2、c(HCl)计算NaOH的纯度.
(3)根据方案三计算NaOH的纯度的表达式为(不必简化):
.






 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.