
科目: 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 硫离子的结构示意图: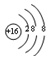 | ||
| C. | N2H4的电子式: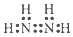 | D. | 丙烯的结构简式:CH2CHCH3 |
查看答案和解析>>
科目: 来源: 题型:解答题
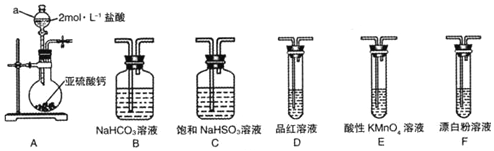
查看答案和解析>>
科目: 来源: 题型:选择题
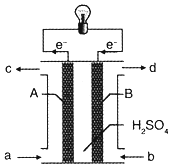 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | A为正极 | |
| B. | 电池工作时H+由A极向B极迁移 | |
| C. | 从b 口通入四氧化二氮气体且在B极发生氧化反应 | |
| D. | A极发生的电极反应式:C2H8N2+4H2O+16e-═2CO2+N2+16H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙烯、苯都能发生加成反应 | |
| C. | 乙烯、聚氯乙烯分子中都含有碳碳双键 | |
| D. | 淀粉、油脂、蛋白质都属于高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体 | |
| D. | 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 |
查看答案和解析>>
科目: 来源: 题型:实验题
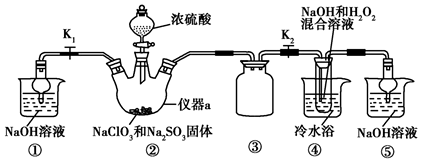
查看答案和解析>>
科目: 来源: 题型:选择题
| 操 作 | 现 象 | 结 论 | |
| A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将FeCl3饱和溶液滴入一定量的沸水中红褐色透明液体,用激光笔照射 | 有丁达尔效应 | 红褐色液体为胶体 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰为黄色 | 原溶液中有Na+、无K+ |
| C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
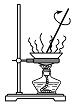 | 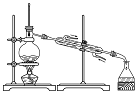 | 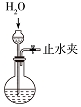 | 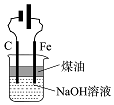 |
| A.蒸发氯化铝溶液的AlCl3 | B.分离乙酸钠和乙醇的混合液 | C.检查装置的气密性 | D.制备Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com