
科目: 来源: 题型:解答题
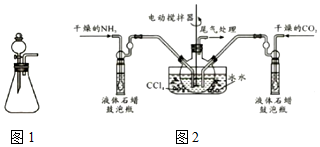
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键 | |
| B. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| C. | lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上 | |
| D. | 80℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
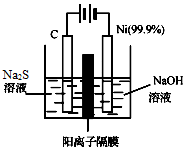 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 30gNO和30gSiO2中含有的氧原子数均为NA | |
| B. | 0.5L2.0mol•L-1NaHSO3溶液中含有的HSO3-数目为NA | |
| C. | 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA | |
| D. | 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA | |
| B. | 1L0.1mol•L-1的Na2CO3溶液中阴离子的总数大于0.1NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2molFe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1mol-CH3中所含的电子总数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
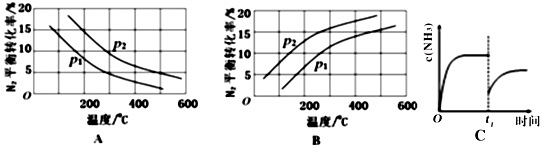
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L空气中O2、N2分子总数目为NA | |
| B. | 0.1 mol羟基中所含电子数目为NA | |
| C. | 28 g乙烯、丙烯混合气体中所含原子数为6NA | |
| D. | 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
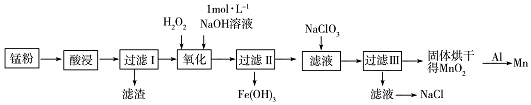
 ,NaClO3中所含的化学键类型有离子键和共价键.
,NaClO3中所含的化学键类型有离子键和共价键.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下将pH=12的氨水加水稀释,稀释过程中溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 同浓度的醋酸钠和醋酸等体积混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃相同pH的①CH3COONa②NaHCO3③NaAlO2三种溶液中的c(Na+):①>②>③ | |
| D. | 浓度均为0.1mol•L-1的KHS和HCl等体积混合液中:c(HS-)+c(H2S)=0.1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com