(2013?长沙模拟)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO
2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
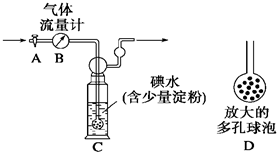
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是
增大SO2与碘水的接触面积,使SO2和碘水充分反应
增大SO2与碘水的接触面积,使SO2和碘水充分反应
.
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO
2含量
偏低
偏低
(填“偏高”、“偏低”或“无影响”).
【乙方案】实验步骤如下面流程图所示:
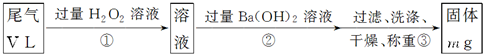
(3)步骤①中过量H
2O
2的作用是
将SO2完全转化为SO42-
将SO2完全转化为SO42-
;
(4)写出步骤②中反应的化学方程式
H2SO4+Ba(OH)2=BaSO4↓+2H2O
H2SO4+Ba(OH)2=BaSO4↓+2H2O
;
(5)步骤②中Ba(OH)
2是否足量的判断方法是
静置分层后,向上层清液中继续滴加Ba(OH)2溶液,若无浑浊现象产生说明Ba(OH)2足量,否则不足
静置分层后,向上层清液中继续滴加Ba(OH)2溶液,若无浑浊现象产生说明Ba(OH)2足量,否则不足
.
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为
(用含有V、m的代数式表示).


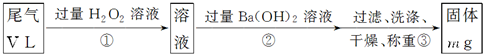
 (2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有