
科目: 来源: 题型:选择题
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
查看答案和解析>>
科目: 来源: 题型:推断题
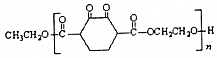 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: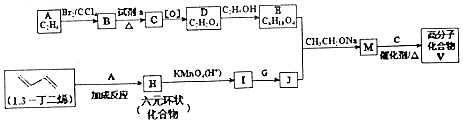
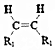 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH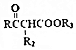 +R1OH
+R1OH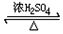 CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.查看答案和解析>>
科目: 来源: 题型:解答题
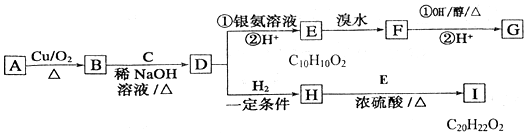
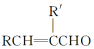 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.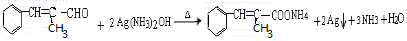 .
. .
.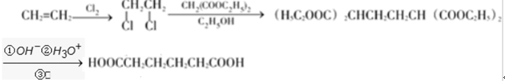 .
.查看答案和解析>>
科目: 来源: 题型:解答题
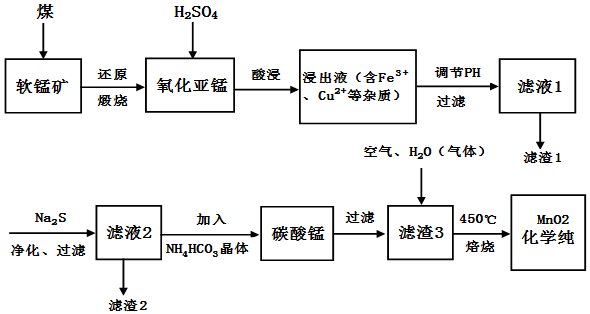
查看答案和解析>>
科目: 来源: 题型:实验题
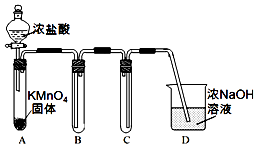 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用排水法收集二氧化氮气体 | |
| B. | 浓硝酸存放于棕色广口试剂瓶中 | |
| C. | 配制氯化亚铁溶液时,将氯化亚铁固体溶解在蒸馏水中加少量盐酸即可 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、B能形成离子化合物,且A离子半径小于B离子半径 | |
| B. | A、D能形成离子化合物DA5,与H2O反应能生成A的单质 | |
| C. | C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 | |
| D. | E的两种氢化物中所有化学键种类完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com