
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃) | 590 | 710 | 770 |
| Na的沸点(℃) | 700 | 830 | 890 |
| KCl的沸点(℃) | 1437 | ||
| NaCl的沸点(℃) | 1465 |
| C(K) |
| C(Na) |
| C(K) |
| C(Na) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
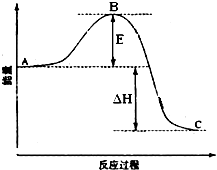 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
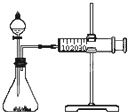 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.查看答案和解析>>
科目: 来源: 题型:
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com