
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
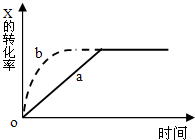 (2013?浦东新区一模)右图曲线a表示放热反应 X(g)+Y(g)+N(s)?Z(g)+M(g)进行过程中X的转化率随时间变化的关系.在其它条件不变时改变某个条件,使反应过程按b曲线进行,可采取的措施是( )
(2013?浦东新区一模)右图曲线a表示放热反应 X(g)+Y(g)+N(s)?Z(g)+M(g)进行过程中X的转化率随时间变化的关系.在其它条件不变时改变某个条件,使反应过程按b曲线进行,可采取的措施是( )查看答案和解析>>
科目: 来源: 题型:
. |
| v |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com