
科目: 来源: 题型:解答题
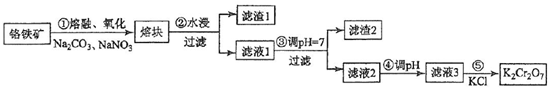
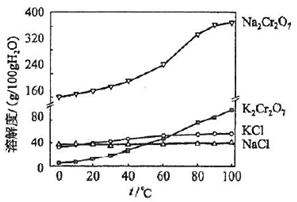
查看答案和解析>>
科目: 来源: 题型:实验题
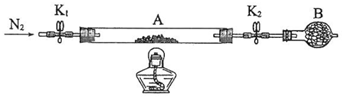
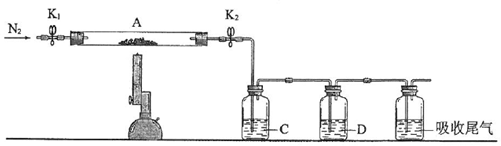
查看答案和解析>>
科目: 来源: 题型:选择题
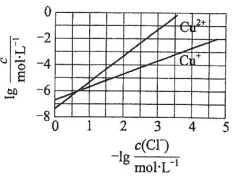 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
查看答案和解析>>
科目: 来源: 题型:选择题
 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )| A. | 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 | |
| B. | 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g | |
| C. | 石墨烯的作用主要是提高电极a的导电性 | |
| D. | 电池充电时间越长,电池中的Li2S2量越多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol 的11B中,含有0.6NA个中子 | |
| B. | pH=1的H3PO4溶液中,含有0.1NA个H+ | |
| C. | 2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 | |
| D. | 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
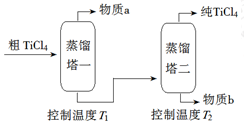
查看答案和解析>>
科目: 来源: 题型:解答题
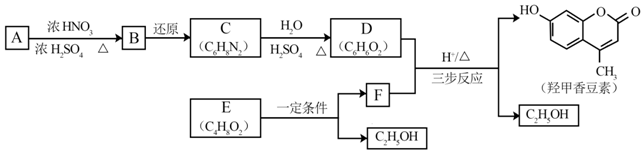
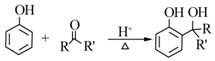
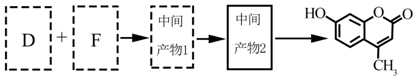
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.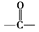 和
和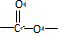 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
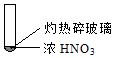 | 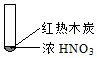 | 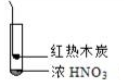 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
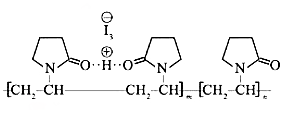 (图中虚线表示氢键)
(图中虚线表示氢键)| A. | 聚维酮的单体是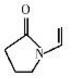 | |
| B. | 聚维酮分子由(m+n)个单体聚合而成 | |
| C. | 聚维酮碘是一种水溶性物质 | |
| D. | 聚维酮在一定条件下能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com