
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目: 来源: 题型:实验题
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
查看答案和解析>>
科目: 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 整个反应过程中,铜相当于催化剂 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | Li电极减轻7g时,至少需消耗空气5.6L(标准状况) |
查看答案和解析>>
科目: 来源: 题型:选择题
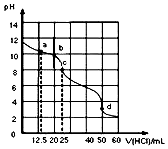 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下,pH=12的NaAlO2溶液中,由水电离得OH-数目为0.01NA | |
| B. | 常温常压下,N2H4和CH3OH的混合物64g含有12NA个原子 | |
| C. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| D. | 苯与液溴反应生成1mol溴苯,消耗0.5NA个Br2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| B. | CO2可与H2在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| C. | 泡过高锰酸钾溶液的硅藻土放于新鲜水果箱内是为了催熟水果 | |
| D. | 生活中常用可溶性铝盐和铜盐净水 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com