
科目: 来源: 题型:选择题
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
查看答案和解析>>
科目: 来源: 题型:选择题
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )| A. | 不能用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+ 1s22s22p63s23p6 | B. | Cu+ 1s22s22p63s23p63d104s1 | ||
| C. | N3- 1s22s22p6 | D. | As 1s22s22p63s23p63d104s24p3 |
查看答案和解析>>
科目: 来源: 题型:解答题

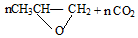 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$


查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 酸雨的pH<5.6 | CO2溶解在雨水中 |
| B | 氢能是能源开发的研究方向 | 化石燃料燃烧放出的热量使水分解产生氢气 |
| C | 稻草、甘蔗渣可用来造纸 | 稻草、甘蔗渣富含纤维素 |
| D | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知:向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池.
已知:向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 瓶中气体的黄绿色逐渐变浅 | |
| B. | 瓶内壁有油状液滴形成 | |
| C. | 此反应的生成物只有一氯甲烷 | |
| D. | 此反应的液态生成物为二氯甲烷、三氯甲烷及四氯化碳的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com