
科目: 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-=CO32-+H2O |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S=2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-=CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题

| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
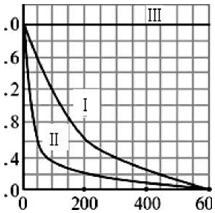
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ②①③⑤④ | C. | ③①②⑤④ | D. | ②③①⑤④ |
查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A. | ①②⑥ | B. | ①②③④⑤ | C. | ①②③④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| B. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| C. | Y物质具有还原性,可以是葡萄糖 | |
| D. | 在1100℃所得混合气体X中O2一定为0.75mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| B. | 碳酸钡与稀硫酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | CuSO4溶液与少量稀氨水反应:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 铁和氯化铁溶液反应:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
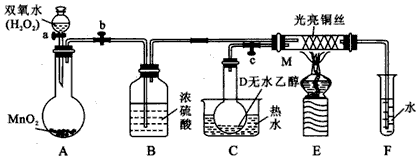
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )| A. | 由图中信息可知,HA一定是强酸 | |
| B. | 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol•L-1 | |
| C. | N点对应的溶液中c(M+)=c(A-) | |
| D. | K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com