
科目: 来源: 题型:选择题
| A. | 2.7g A1与NaOH溶液完全反应,转移的电子数为0.2NA | |
| B. | 常温下,2.24L N2和O2的混合气体分子数为0.1NA | |
| C. | O.1 mol的14C中,含有的电子数为0.8NA | |
| D. | 0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,容器中气体分子总数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:实验题
 按如图所示装置进行实验,以制取乙酸乙酯.
按如图所示装置进行实验,以制取乙酸乙酯.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该电池的缺点是存在副反应:2Li+2H2O═2LiOH+H2↑ | |
| B. | 放电时,正极反应为Li1-xMn2O4+xLi++xe-═LiMn2O4 | |
| C. | 充电时,电极 b 为阳极,发生氧化反应 | |
| D. | 放电时,Li+穿过固体薄膜进入到水溶液电解质中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目: 来源: 题型:实验题
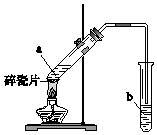 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. 查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为7NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1NH4Cl溶液中,NH4+的数量为0.1NA | |
| B. | 标准状况下,2.24 LN2和O2的混合气体中分子数为0.2NA | |
| C. | 1molCl2 完全反应,转移的电子数一定为 2NA | |
| D. | 14 g 乙烯和丙烯混合气体中的氢原子数为 2NA |
查看答案和解析>>
科目: 来源: 题型:填空题

 +2NaOH$→_{.}^{△}$
+2NaOH$→_{.}^{△}$ +CH3OH+NaCl
+CH3OH+NaCl
 +nNaOH$→_{.}^{△}$
+nNaOH$→_{.}^{△}$ +nCH3OH
+nCH3OH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com