
科目: 来源: 题型:选择题
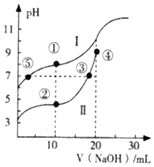 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
查看答案和解析>>
科目: 来源: 题型:选择题
 用AG表示溶液酸度:AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.在室温下,用0.1mol/L的HCl溶液滴定20.00mL0.1mol/L氨水.滴定结果可表示如图:下列分析正确的是( )
用AG表示溶液酸度:AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.在室温下,用0.1mol/L的HCl溶液滴定20.00mL0.1mol/L氨水.滴定结果可表示如图:下列分析正确的是( )| A. | 0.lmol/L 氨水 pH=10.2 | |
| B. | A点加入盐酸的体积为20.00mL | |
| C. | 若a=7,从A到B水的电离程度逐渐减小 | |
| D. | B点溶液中可能存在c(Cl-)>c(NH4+)>(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 洁净煤技术(CCT)是煤的高效清洁利用的技术.煤中的硫主要以黄铁矿(FeS2)为主,其次为磁硫铁矿(Fe7S8)、闪锌矿(ZnS)、方铅矿(PbS)等.回答下列问题:
洁净煤技术(CCT)是煤的高效清洁利用的技术.煤中的硫主要以黄铁矿(FeS2)为主,其次为磁硫铁矿(Fe7S8)、闪锌矿(ZnS)、方铅矿(PbS)等.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:| A. | 三种溶液各取10 mL混合,然后滴定,沉淀先后顺序为Cl-、Br-、I- | |
| B. | 滴定Cl-时,可加人少量的KI作指示剂 | |
| C. | 当滴定AgNO3溶液至70.00mL时,溶液中c(I-)>c (Br-)>c(Cl-) | |
| D. | 滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A. | 常温下,PbI2的Ksp为2×10-6 | |
| B. | 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 | |
| C. | T时刻改变的条件是升高温度,因而PbI2的Ksp增大 | |
| D. | 常温下Ksp(PbS)=8×10 -28,向PbI2的悬浊液中加入Na2S溶液,PbI2 (s)+S2- (aq) PbS(s)+2I- (aq)反应的化学平衡常数为5×l018 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | N2分子中有一个σ键,2个π键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 由水电离出c(H+)=10-3mol/L的溶液中:Na+、[Al(OH)4]-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量共存在Fe3+、NH4+、Cl-、S2- | |
| D. | 1mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用到的玻璃仪器只有有:玻璃棒、烧杯 | |
| B. | 洗净的容量瓶必须干燥后才能用 | |
| C. | 称量2.0g氢氧化钠固体 | |
| D. | 没有等溶液冷却就转移,或定容时俯视,均导致所配溶液浓度偏低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com