
科目: 来源: 题型:
 (2013?江苏二模)图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
(2013?江苏二模)图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色 液体 |
无色 液体 |
深红棕色 液体 |
| 密度/g?cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
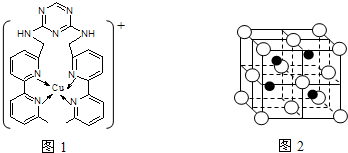
查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:
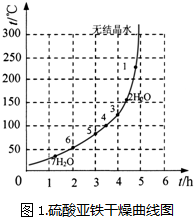
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目: 来源: 题型:阅读理解

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com