
科目: 来源: 题型:
 pC(g)+qD(g)在一密闭容器中进行,测得平均反应速度v(C)=2v(B).若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速度v(C)=2v(B).若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )查看答案和解析>>
科目: 来源: 题型:
 在容积固定的4L密闭容器中,进行可逆反应:X(g)+2Y(g)
在容积固定的4L密闭容器中,进行可逆反应:X(g)+2Y(g) 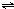 2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )
2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
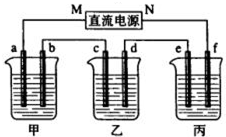 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目: 来源: 题型:
 (2008?上海)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(2008?上海)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com